Themenspezial #PBCinnovation - Part II
Ergebnisse der Miniumfrage
- Wir haben im Rahmen unserer Umfrage bis dato über 100 Antworten sammeln können und möchten Ihnen gerne die Ergebnisse zukommen lassen
- Es zeigt sich, dass großes Interesse am Thema klinische Studien besteht, obwohl die überwiegende Mehrheit der Befragten bisher noch nicht mit dem Thema klinische Studien konfrontiert war.
- 60% der Befragten sind prinzipiell an einer Studien-Teilnahme interessiert, 42% hätten gerne mehr Informationen zum Thema. Nur 6% der Befragten geben an, dass die Teilnahme an einer klinischen Studie für sie nicht in Frage kommt.
- Die Befragten, die an Studien teilgenommen haben (20 von 110), berichten überwiegend über positive Erfahrungen. (Abbildung 1)
- Regelmäßig gleicher Ansprechpartner
- Umfassende Aufklärung
- Engmaschige Betreuung
- Weitreichende Untersuchungen bekommen
(Abbildung 1)
- Negative Aspekte (2/20)
- Schlecht verständliche Aufklärung
- Keine Möglichkeit weitergehende Fragen zu stellen
- Neben Vorteilen, die die Befragten für sich selbst sehen, ist eine überraschend hohe uneigennützige Motivation zu verzeichnen.
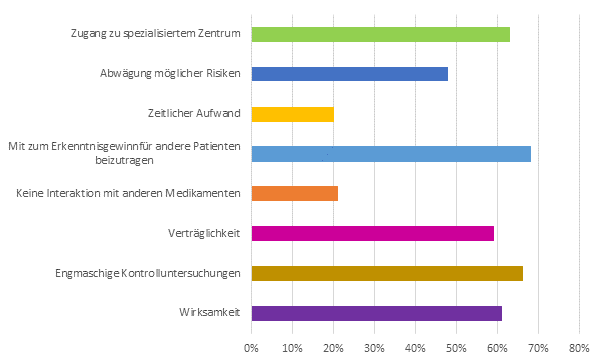
(Abbildung 2)
Möglichkeiten für Patienten sich an Studien zu beteiligen
- Ihr Arzt spricht Sie auf eine Studienteilnahme an – Sie erhalten ausführliche Informationen zum Ablauf der Studie, welche Vorstellungstermine im Studienzentrum anstehen und welche Untersuchungen dort durchgeführt werden. Zudem sollten Sie sorgfältig zu möglichen Risiken aufgeklärt werden. Lesen Sie alles sorgfältig durch und fragen Sie bei allen Unklarheiten nach, auch wenn es noch so banal erscheint! Sie müssen eine Einwilligungserklärung zur Teilnahme unterschreiben und bestätigen, dass ein Aufklärungsgespräch stattgefunden hat und Sie alles verstanden haben.
- Selbstverständlich können Sie sich auch eigen-initiativ zu laufenden Studien informieren und Ihren behandelnden Facharzt auf die Möglichkeit einer Teilnahme ansprechen. Für klinische Studien sind immer sogenannte Einschlusskriterien definiert, die festlegen, welche Patienten an der betreffenden Studie teilnehmen können. Diese Kriterien können Alter, Geschlecht und allgemeiner Gesundheitszustand, aber auch weitere klinische Erkrankungsparameter wie Blutwerte und/oder der Fibrosegrad und/oder andere sein.
Als Informationsquellen bieten sich an:- es gibt verschiedene öffentliche Listen zu klinischen Studien auf nationaler, europäischer und globaler Ebene in Deutsch und English. Eine gute Übersicht bietet hier
https://www.kks-netzwerk.de/studiensupport/unterstuetzung/register/ - Wir haben für Sie eine Anleitung zusammengestellt, damit Sie sich auf den Listen bestens zurechtfinden.
 Schauen Sie sich unser Tutorial an, damit Sie zielgerichtet die Studie finden, die Sie interessiert.
Schauen Sie sich unser Tutorial an, damit Sie zielgerichtet die Studie finden, die Sie interessiert. - da die Suche nach relevanten Informationen in den einzelnen Datenbanken komplex sein kann, haben wir mit Unterstützung unseres wissenschaftlichen Beiratsmitgliedes Herrn Prof. Kahraman eine Auswahl von klinischen Studien, die derzeit in Deutschland, erstellt – berücksichtigt sind hier Phase III Zulassungsstudien; die Informationen in dieser Liste werden halbjährlich aktualisiert
Name der Studie
Studienzentren in Deutschland
Studie für Patienten mit PBC
Berlin
Hamburg
Tübingen
Erlangen
Herne
Kiel
Studie für Patienten mit PBC und Lebersteifigkeit (TRANSFORM)
Homburg/Saar
München
Frankfurt
Wiesbaden
Hannover
Leipzig
Studie zu Juckreiz bei PBC (GLISTEN)
Erlangen
Essen,
Münster
Homburg/Saar
Langzeitstudie zu Juckreiz bei PBC zur Sicherheit und Verträglichkeit
Erlangen
Quelle: https://www.clinicaltrials.gov Stand der Information 10. Juni 2024
- es gibt verschiedene öffentliche Listen zu klinischen Studien auf nationaler, europäischer und globaler Ebene in Deutsch und English. Eine gute Übersicht bietet hier
- Die Durchführung von klinischer Forschung wird von verschiedenen Behörden und Institutionen gemäß ihrem gesetzlichen Auftrag geprüft und überwacht. Hierbei finden weltweit vereinbarte ethische Grundsätze Anwendung, die die Rechte der Studienteilnehmer schützen.
- BfArM (Bundesinstitut für Arzneimittel und Medizinprodukte): ist als eine der beiden Bundesoberbehörden Genehmigungsstelle für klinische Prüfungen, d.h. vor Beginn einer klinischen Prüfung mit Arzneimitteln am Menschen eine Genehmigung bei der zuständigen Bundesoberbehörde einzuholen. Datenschutzrechtliche Belange werden in Teilen vom BfArM geprüft, ein weiterer Teil obliegt der nach Landesrecht gebildeten zuständigen Ethikkommissionen, die ebenfalls vor Beginn einer klinischen Prüfung eine zustimmende Bewertung abgeben muss.
https://www.bfarm.de/DE/Arzneimittel/Klinische-Pruefung/Genehmigungsverfahren/_node.html;jsessionid=9B0901E4743F69DABF461E5067B625DA.intranet261 - PEI (Paul Ehrlich Institut, Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel): In Deutschland ist das Paul-Ehrlich-Institut (PEI) für die Prüfung klinischer Studien im Bereich der Impfstoffe und biomedizinischen Arzneimittel zuständig.
https://www.pei.de/DE/home/home-node.html https://www.pei.de/DE/regulation/klinische-pruefung/klinische-pruefung-node.html - Ethikkommissionen: sind von Universitäten, berufsständischen Vereinigungen oder Ländern eingerichtete Kommissionen, die Wissenschaftler in ethischer und rechtlicher Hinsicht beraten und überwachen sollen, die Forschung am lebenden und am verstorbenen Menschen planen, darunter auch klinische Studien. Als generelles ethisches Prinzip wird der Schutz der Teilnehmer an einer Studie über die Freiheit der Wissenschaft gestellt. Vor allem in der Medizin, aber auch in der Psychologie und anderen Disziplinen gehören Prüfungen und Genehmigungen solcher Forschungsprojekte zunehmend zum Standard. Sie sollen so Rechte und Sicherheit der Teilnehmer im Sinne der Deklaration von Helsinki schützen.
- Deklaration von Helsinki: eine Deklaration des Weltärztebundes zu ethischen Grundsätzen für die medizinische Forschung am Menschen. Sie wurde von der 18. Generalversammlung des Weltärztebundes in Helsinki im Juni 1964 verabschiedet und seither mehrfach überarbeitet. Die aktuelle Fassung finden sie hier: https://www.bundesaerztekammer.de/fileadmin/user_upload/_old-files/downloads/pdf-Ordner/International/Deklaration_von_Helsinki_2013_20190905.pdf
- BfArM (Bundesinstitut für Arzneimittel und Medizinprodukte): ist als eine der beiden Bundesoberbehörden Genehmigungsstelle für klinische Prüfungen, d.h. vor Beginn einer klinischen Prüfung mit Arzneimitteln am Menschen eine Genehmigung bei der zuständigen Bundesoberbehörde einzuholen. Datenschutzrechtliche Belange werden in Teilen vom BfArM geprüft, ein weiterer Teil obliegt der nach Landesrecht gebildeten zuständigen Ethikkommissionen, die ebenfalls vor Beginn einer klinischen Prüfung eine zustimmende Bewertung abgeben muss.
- Nachdem der Arzt die Teilnahme an einer klinischen Studie angeboten hat, benötigen die meisten Patienten eine gewisse Zeit, um in Ruhe abzuwägen, was für und was gegen eine Studienteilnahme spricht. Sprechen Sie auch mit Familienangehörigen und/oder Freunden, dies kann helfen Ihre Gedanken zu schärfen. Nehmen Sie sich hier die Zeit, die Sie benötigen und lassen Sie sich von niemandem zu einer vorschnellen Entscheidung drängen!
Im Folgenden finden Sie eine Liste von Punkten, die für eine Entscheidungsfindung relevant sein können und Sie in Ihrer persönlichen Abwägung von Pro und Contra unterstützen sollen.

Liste anzeigen
Exkurs
Wie kommt es eigentlich, dass in einer Erkrankung viele Jahre gar nichts passiert und dann auf einmal eine Vielzahl von neuen Substanzen erprobt und in klinischen Studien untersucht werden? PBC ist hier ein gutes Beispiel, nach der Einführung von UDCA im Jahr 1989 hat es über 25 Jahre gedauert bis mit OCA 2017 eine zweite Therapieoption zur Verfügung stand.
Grundlagenforschung zu pathophysiologischen Phänomenen und biologischen Prozessen ist die Grundlage zur Entdeckung und Entwicklung entsprechend wirksamer Substanzen. Hierbei können auch neu entwickelte wissenschaftliche Methoden als eine Art Türöffner in eine neues Verständnis der Erkrankung, ihres Verlaufs und Angriffsmöglichkeiten eine entscheidende Rolle spielen. Solche grundlegenden Erkenntnisse können wiederum eine Welle von neuen Molekülen generieren, die weiter optimiert werden und schlussendlich in die klinische Entwicklung kommen.
Ein Beispiel in diesem Kontext ist das wachsende Verständnis der Signalwege von Gallensäuren im Körper. Gallensäuren sind körpereigene Substanzen, die von der Leber gebildet werden und im Darm für die Verdauung und Resorption von Fetten verantwortlich sind.
Grundlagenforschung ergab in den letzten Jahren, dass sie darüber hinaus als spezielle Hormone Informationen zwischen Darm, Leber und vielen Organen des Körpers vermitteln. Sie binden an verschiedene Rezeptoren, über die Signalwege ausgelöst werden. Diese wirken auf bestimmte Gene und nehmen so Einfluss auf Entzündungs- und immunologische Abwehrprozesse, sowie auf den Energiehaushalt des Körpers.
Die wichtigsten Signalwege, über die Gallensäuren auf die verschiedenen Körperfunktionen wirken, sind mittlerweile bekannt und man hofft, sie mit Blick auf einen eventuellen therapeutischen Nutzen günstig beeinflussen zu können. Insbesondere ein Rezeptor (der Farnesoyl-X-Rezeptor FXR) ist Gegenstand solcher Untersuchungen geworden. Ursodesoxycholsäure (UDCA) und inzwischen auch Obeticholsäure (OCA), die FXR aktivieren, sind als Medikamente für PBC zugelassen.
Auch bei der Entstehung von cholestatischem Juckreiz spielen Gallensäuren eine Rolle. Diese Rolle genau zu verstehen und für mögliche therapeutische Anwendung nutzbar zu machen, ist Gegenstand aktueller Forschung.
Hätten Sie Interesse, sich mit anderen Patienten zum Thema klinische Studien persönlich auszutauschen und/oder die Erfahrungen von Patienten, die an klinischen Studien teilgenommen haben, aus erster Hand zu hören? Dann lassen Sie uns das wissen! Schicken Sie uns eine kurz Nachricht an post@kautzhoch5.de, bei ausreichendem Interesse organisieren wir gerne eine solche Möglichkeit zum Austausch!
Vielen Dank an den wissenschaftlichen Beirat – Prof. Dr. Tony Bruns, Dr. Rainer Günther, Prof. Dr. Hauke Heinzow, Prof. Dr. Alisan Kahraman, Prof. Dr. Ingolf Schiefke, Dr. Karl-Georg Simon und Prof. Dr. Johannes Wiegand.
Mit freundlicher Unterstützung von GlaxoSmithKline GmbH & Co. KG, München.
Gendergerechte Sprache: Dieser Text schließt prinzipiell alle Geschlechter mit ein. Zur besseren Lesbarkeit wird jedoch nur eine Geschlechtsform verwendet
