Themenspezial #PBCinnovation - Part I
Primär Biliäre Cholangitis (PBC) ist eine chronische Autoimmunerkrankung der Leber. Ganz allgemein formuliert werden bei einer Autoimmunerkrankung körpereigene Gewebe oder Zellen vom eigenen Abwehrsystem als fremd angesehen und bekämpft. Bei der PBC werden die kleinen Gallengänge in der Leber durch einen Autoimmunprozess geschädigt. Wird die PBC nicht behandelt, kann es zu anhaltenden Leberschäden kommen, sodass die Leber ihre wichtigen Aufgaben für den Gesamtorganismus nur noch eingeschränkt oder gar nicht mehr erfüllen kann.
Durch Anklicken des Bildes wird das Video geladen und Sie akzeptieren die Datenschutzerklärung von YouTube. Mehr erfahren.
Um den Verlauf einer PBC im Blick zu behalten, werden in regelmäßigen Abständen verschiedene Untersuchungen durchgeführt, u.a. die Bestimmung des Blutwertes Alkalische Phosphatase (AP). Eine Erhöhung des AP-Werts kann auf eine Erkrankung von Leber und Gallenwegen hindeuten. Es hat sich gezeigt, dass Therapien den AP-Wert im Blut senken können und die Patienten so von einer verbesserten Prognose profitieren.
Durch Anklicken des Bildes wird das Video geladen und Sie akzeptieren die Datenschutzerklärung von YouTube. Mehr erfahren.
Wie in einer deutschlandweit durchgeführten Untersuchung (n=936) gezeigt werden konnte, leidet die Mehrheit der PBC-Patienten an Symptomen wie Juckreiz, Müdigkeit, Gelenkschmerzen, Trockenheit der Schleimhäute (Sicca-Syndrom) und anderen, die die Lebensqualität beeinträchtigen.
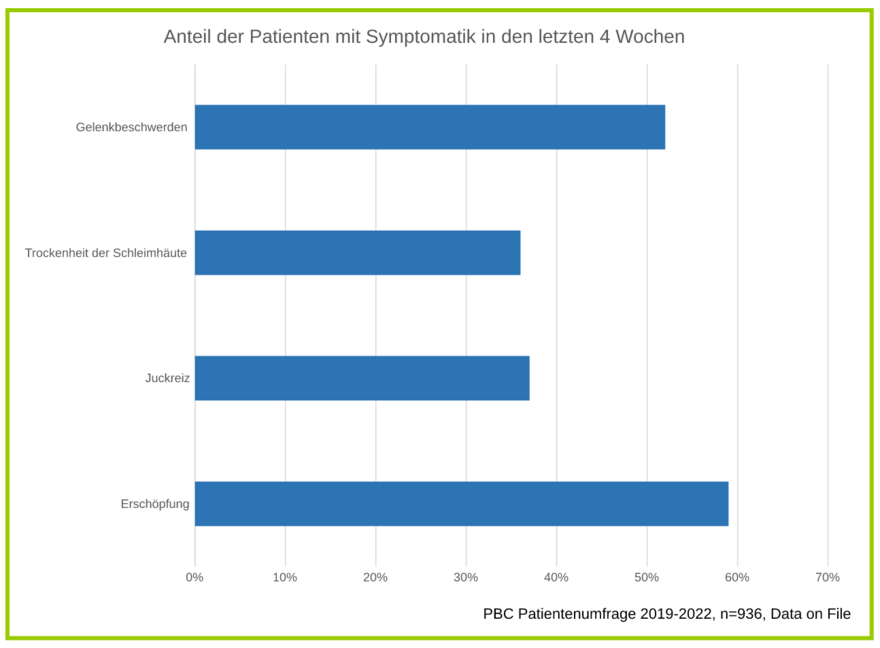
Viele Patienten berichteten im Rahmen dieser Untersuchung außerdem, dass sich nur wenige Ärzte einem ganzheitlichen Symptommanagement widmen und ihre Symptome mit den vorhandenen medizinischen und nicht-medizinischen Möglichkeiten nicht optimal versorgt werden können. Es besteht also ein großer Bedarf an neuen Behandlungsoptionen für die PBC und ihre Symptome.
Leider ist es mir nicht bei allen meinen PBC Patienten möglich, ihre Symptome gut zu managen. Insbesondere Juckreiz und Erschöpfung stehen hier für mich im Mittelpunkt. Mir ist bewusst, dass das für die Patienten unbefriedigend sein kann, und das ist es auch für mich als Arzt und deshalb bin ich bemüht, die Entwicklung neuer innovativer Therapien mit voranzubringen.

Prof. Kahraman, Baden-Baden
Doch wie werden die benötigten neuen Wirkstoffe entwickelt und wie finden sie ihren Weg in die klinische Versorgung? Und warum ist es wichtig, von Anfang an Patienten mit einzubeziehen?
Um diese Fragen soll es in diesem Spezial gehen und hierfür benötigen wir Ihre aktive Unterstützung und Mitwirkung. Wir sind an Ihren Erfahrungen, Bedürfnisse, aber auch Bedenken interessiert. Nur mit Ihrer Unterstützung können wir dazu beitragen, dass klinische Forschung die Bedürfnisse von Patienten berücksichtigt und schneller vorangetrieben werden kann.
Daher bedanken wir uns jetzt schon für Ihre aktive Teilnahme in dieser Umfrage!
Wie funktioniert klinische Forschung? Wie werden neue Medikamente entwickelt?
Momentan verfügbare Medikamente, Behandlungs- oder Untersuchungsmethoden reichen oft nicht aus, um eine Erkrankung zu heilen oder ausreichend zu kontrollieren. Daher beschäftigen sich viele Forscher und Ärzte mit der Entwicklung neuer oder der Verbesserung bereits vorhandener Medikamente, Behandlungs- oder Untersuchungsmethoden. Dazu wird jahrelang in Laboren und Kliniken geforscht.
Zum Einsatz am Menschen kommt ein neuer Wirkstoff erst, wenn er sich in vorklinischen Studien bewährt hat. In klinischen Studien mit Patienten wird dann die Wirksamkeit und Sicherheit eines neuen Medikaments im klinischen Einsatz überprüft.
Auch in der PBC gibt es weltweit Bemühungen neue Medikamente zu entwickeln. Nicht nur für die Behandlung der Grunderkrankung, sondern auch für die vielfältigen Symptome der PBC.
Worauf konzentriert sich die aktuelle Forschung bei PBC?
Zu PBC wird aktuell intensiv geforscht, neben Grundlagenforschung zum besseren Verständnis der Ursachen und Mechanismen, die bei der Entstehung einer PBC eine Rolle spielen, stehen drei große Themen im Zentrum aktueller Forschungsbemühungen:
-
Biochemisches Ansprechen: Wie können die relevanten Blutwerte weiter verbessert werden? Welchen Stellenwert hat hierbei die Wahl der Zweitlinientherapie? Welche Blutwerte sollten erreicht werden, um langfristig das Fortschreiten der PBC aufzuhalten und damit Leberkomplikationen zu vermeiden?
-
Juckreiz: Was sind die Mechanismen, die den cholestatischen Juckreiz auslösen? Wie kann der Juckreiz ursächlich behandelt werden? Hier laufen derzeit klinische Studien für die Entwicklung neuer Medikamente.
-
Erschöpfung: Was sind die Ursachen für Erschöpfung und wie kann sie behandelt werden? In diesem Bereich werden neue Medikamente aber auch Achtsamkeitsprogramme im Rahmen von klinischen Studien untersucht.
Sprechen Sie mit Ihrem behandelnden Arzt, wenn Sie an Informationen zu laufenden klinischen Studien interessiert sind.
Damit Sie einen Überblick über alle Aspekte von klinischen Studien bekommen, haben wir für Sie die wichtigsten Aspekte zusammengestellt.
1. Was sind klinische Studien?
Grundsätzlich sind zwei Studientypen zu unterscheiden:
Erfahren die Teilnehmer eine aktive Form von Behandlung, spricht man von interventionellen Studien oder Arzneimittelstudien. Eine Intervention ist eine geplante und gezielte Maßnahme, die den Ausbruch oder das Fortschreiten einer Erkrankung verhindern soll. Das kann beispielsweise die Einnahme eines neuen Arzneimittels sein.
Beobachtungsstudien ohne jegliches Eingreifen werden dagegen nicht-interventionelle Studien genannt.
2. Welche Regeln gibt es bei der Durchführung einer klinischen Studie?
Die Teilnahme an einer Studie ist grundsätzlich und immer freiwillig.
Information und Aufklärung:
Die wichtigste Regel vor der Teilnahme an einer klinischen Studie ist eine umfassende Aufklärung. Jede Klinik/Praxis hat die Auflage, den Patienten über den Nutzen, den Ablauf, die Untersuchungsmethoden und das Risiko einer klinischen Studie zu informieren. Darüber hinaus ist die Klinik/Praxis dazu verpflichtet, umfassend über Datenschutz- und Versicherungsaspekte zu informieren.
Dies geschieht im Rahmen eines ausführlichen Aufklärungsgesprächs, das entsprechend dokumentiert sein muss und alle Informationen in Schriftform zur Verfügung stellt. Erst wenn alles verstanden wurde, darf eine Klinik/Praxis die schriftliche Einwilligungserklärung den Patienten übergeben. Die Patienten müssen nicht vor Ort unterschreiben, sondern sollen sich ein paar Tage Bedenkzeit nehmen, um sich in Ruhe mit den Informationen auseinanderzusetzen.
Abbruch:
Jeder Studienteilnehmer hat zu jedem Zeitpunkt das Recht, seine Teilnahme an der klinischen Studie ohne Angabe von Gründen zu widerrufen und die Studienteilnahme zu beenden. Darüber hinaus ist die Klinik/Praxis verpflichtet, die Teilnehmer regelmäßig über Nebenwirkungen zu informieren und gegebenenfalls sofort gegenzusteuern.
Versicherungsschutz:
Es dürfen keine klinischen Studien durchgeführt werden, wenn die Klinik/Praxis den Studienteilnehmern keinen umfassenden, kostenfreien Versicherungsschutz anbietet.
Die 5 Phasen der klinischen Arzneimittelforschung
-
Die präklinische Studienphase umfasst mehrere Entwicklungsstufen, die Voraussetzung dafür sind, das Medikament in der späteren klinischen Studienphase beim Menschen einzusetzen. In dieser Phase werden unter anderem mögliche schädliche Wirkungen untersucht (z.B. ob der Wirkstoff das Erbgut verändert, oder möglicherweise Krebserkrankungen auslösen kann). Dies geschieht in aller Regel mittels Zellkulturen oder wenn nötig auch in Tierversuchen. Sowohl die präklinische als auch die klinische Studienphase unterliegen strengen, international geltenden Regeln. Erst wenn ein Wirkstoff die präklinische Studienphase erfolgreich durchlaufen hat, darf er in klinischen Studien am Menschen eingesetzt werden.
-
Phase I-Studien sind kleine Studien, in denen eine neue Behandlung erstmals am Menschen eingesetzt wird, und zwar an gesunden Freiwilligen. In diesem Stadium werden grundlegende Eigenschaften wie Verträglichkeit und Sicherheit eines neuen Medikaments überprüft.
-
Phase II-Studien sind bereits etwas größer angelegt. Sie umfassen meist 100 bis 300 Teilnehmende. In Phase II wird ein Medikament zum ersten Mal an Patienten überprüft, die an der Erkrankung leiden, für deren Behandlung das Medikament entwickelt wird. Dabei geht es vor allem um die Bestimmung der optimalen Dosis. Zusätzlich werden erste Daten zur Wirksamkeit erhoben.
-
Phase III-Studien sind große Studien. Sie sollen präzise Auskunft über die Wirksamkeit und Verträglichkeit des Wirkstoffes geben und sind oft als Vergleichsstudien konzipiert. Dabei werden die Patienten, die die zu untersuchende Behandlung erhalten, mit einer Kontrollgruppe verglichen, die eine zugelassene Vergleichstherapie oder ein Placebo erhält.
-
Phase IV-Studien finden statt, wenn ein Medikament bereits auf dem Markt ist. So kann es sinnvoll sein, ein bereits zugelassenes Medikament bei Patienten mit bestimmten Eigenschaften – etwa Alter oder bestimmte Vorerkrankungen – noch einmal gezielt zu untersuchen. Phase IV-Studien können zudem seltene Nebenwirkungen eines Medikaments besser erkennen, weil die Anzahl der behandelten Patienten größer ist.
3. Wer garantiert die Sicherheit in einer klinischen Studie?
Die Sicherheit der Studienteilnehmenden hat bei der Durchführung einer klinischen Studie allerhöchste Priorität. Dementsprechend gibt es strenge ethische Standards für klinische Studien in Form von Auflagen und Gesetzen, die von Forschern und von pharmazeutischen Unternehmen eingehalten werden müssen.
In Deutschland kontrollieren sowohl das sowohl das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) oder das Paul-Ehrlich-Institut (PEI) die Einhaltung der Standards. Zusätzlich muss für jede Studie eine Ethikkommission ihre Zustimmung geben. Die Ethikkommission ist zusammengesetzt aus:
- nicht an der Studie beteiligten Ärzten
- Patientenvertretern
- Juristen
- weiteren unabhängigen Experten.
4. Was sind die Vorteile einer Teilnahme an einer klinischen Studie?
Ein Vorteil für Sie als Patient, an einer klinischen Studie teilzunehmen, ist der Zugang zu neuen Behandlungen. Zudem werden Sie während der Studie engmaschig überwacht, untersucht und betreut. Ein weiterer Aspekt ist, dass Sie zur Entwicklung wirksamer und sicherer Behandlungen mit beitragen.
5. Was sind mögliche Nachteile einer Teilnahme an einer klinischen Studie?
Ein möglicher Nachteil einer Teilnahme an einer klinischen Studie kann sein, dass die neue Behandlung weniger wirksam ist als die bisher verfügbare oder dass sie gar keine Wirkung hat. Zudem können unvorhersehbare Nebenwirkungen auftreten. Ebenso kann es sein, dass Sie der Kontrollgruppe zugeordnet werden und möglicherweise ein Scheinmedikament erhalten. Grundsätzlich müssen Sie regelmäßige Termine wahrnehmen.
Vielen Dank an den wissenschaftlichen Beirat – Prof. Dr. Tony Bruns, Dr. Rainer Günther, Prof. Dr. Hauke Heinzow, Prof. Dr. Alisan Kahraman, Prof. Dr. Ingolf Schiefke, Dr. Karl-Georg Simon und Prof. Dr. Johannes Wiegand.
Mit freundlicher Unterstützung von GlaxoSmithKline GmbH & Co. KG, München.
Gendergerechte Sprache: Dieser Text schließt prinzipiell alle Geschlechter mit ein. Zur besseren Lesbarkeit wird jedoch nur eine Geschlechtsform verwendet
Quellen
https://www.gesundheitsforschung-bmbf.de/de/wie-funktionieren-klinische-studien-6877.php,
https://de.wikipedia.org/wiki/Klinische_Studie
https://www.bfarm.de/DE/Arzneimittel/Klinische-Pruefung/Ethik-Kommissionen/_node.html
NP-DE-LNR-WCNT-220001, Jan23


